
前言
近日,健合集团创新研究中心联合华南理工大学,在乳品科学相关期刊《International Dairy Journal》上发表了一项最新研究成果[1]。该项目由华南理工大学食品科学与工程学院张斌教授以及健合集团创新研究中心刘斐童博士共同主持,该研究揭示了不同婴儿肠型的2′-岩藻糖基乳糖(2’-FL)体外粪便发酵代谢产物对肠上皮细胞损伤的保护作用。近期,2’-FL已被获批可应用于婴幼儿食品,该研究为开发个性化营养的婴幼儿配方产品提供了新的思路。 背景 母乳低聚糖HMO是母乳中的第三大固体营养成分,其中2′-FL是母乳中含量最丰富的HMO,可以通过抑制肠道炎症和调节肠道微生物群来调节肠道疾病[2]。然而,来自不同肠型的2′-FL发酵代谢物(FMs)对肠道炎症和屏障功能的影响仍不清楚,因此本研究使用2′-FL作为发酵底物,用B. longum、B. breve和Bacteroides占优势的婴儿粪便接种物进行体外发酵,并将2′-FL发酵代谢物应用于脂多糖(LPS)诱导的肠上皮细胞损伤模型中。旨在评估FMs在减轻LPS诱导的Caco-2细胞单层炎症中的肠道屏障损伤方面的作用。 主要结论 1. 以B. longum和B. breve为主的肠型发酵2’-FL产生的乙酸盐(77 ~ 94mm)、乳酸盐(16mm)和琥珀酸盐(2mm)均显著高于对照,丙酸盐和丁酸盐仅在Bacteroides肠型中存在。 2. 三种肠型2’-FL代谢产物均能显著提高LPS 诱导的受损 Caco-2细胞的 TEER值(p < 0.05),且B. breve组和 Bacteroides组比乙酸盐组更有优势。随着浓度的上升,各干预组的TJ蛋白表达量也在增加(除了Bacteroides组的 Occudin和Claudin-3)。 3. 三种肠型2’-FL代谢产物均能降低细胞炎症因子的表达,但是不同肠型发酵产物调节炎症细胞因子和介质表达水平的能力不同。 4. 三种2’-FL发酵上清液一方面能够抑制NF-κB通路,另一方面能够激活Nrf2/HO-1通路,减少炎症因子的产生,并且修复肠屏障功能,且Bacteroides-dominated肠型效果更佳。 研究方法 本研究使用2′-FL作为发酵底物,用B. longum (BL group)、B. breve (BB group)和Bacteroides (BA group)占优势的婴儿粪便接种物进行体外发酵,并评估2′-FL发酵代谢物对脂多糖(LPS)诱导的肠上皮细胞损伤的保护作用。通过对 2’-FL代谢产物干预细胞后的跨膜电阻值、炎症反应表达、紧密连接蛋白和细胞信号通路等特征进行解析,以进一步阐明2’-FL代谢产物保护肠屏障的功能机理。 研究结果 1. 代谢产物分析 表1. 不同婴儿肠型2′-FL发酵24小时后检测到的FMs水平 通常,肠道微生物群衍生的代谢物(如SCFAs、乳酸盐和琥珀酸盐)的产生和组成因特定的饮食类型和微生物群结构而异[3]。表1显示了不同婴儿肠型中2′-FL 发酵后代谢产物的产生。以B. longum和B. breve为主的接种物产生较高量的乙酸(77-94 mM)、中等水平的乳酸(~16 mM)和少量的琥珀酸(~2 mM)。而以Bacteroides为主的接种物在发酵过程中产生最高的琥珀酸浓度(14.35 mM,表1) ,较高的乙酸浓度(92.87 mM),和最低的乳酸浓度(3.09 mM),且丙酸盐和丁酸盐仅在拟杆菌优势菌群中存在。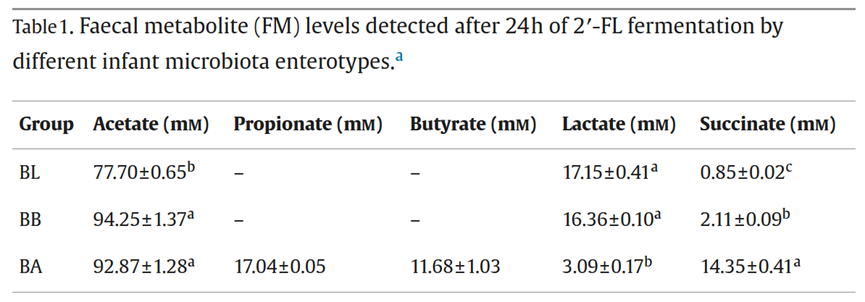
2. 肠道屏障完整性 图1. 不同肠型FMs对受损肠上皮细胞屏障功能的影响。(A)TEER值,(B)ZO-1、(C)ZO-2、(D)Occudin、(E)Claudin-1和(F)Claudiin-3的mRNA水平 所有FMs逆转了 LPS 诱导的肠通透性增加(图1A),并且TEER对不同浓度的FM 处理呈现剂量依赖性增加。值得注意的是,与相应浓度的醋酸盐对照相比,BB 和 BA 组显示出显著更高的 TEER 值,可能是由于体外发酵后与 BB和BA 组相关的乙酸产量(~ 93mm)。与 BB 和 BA 组相比,BL 组在相应的处理浓度下含有较少的乙酸产生,因此显示出显著较低的TEER 值(p < 0.05, 图1A)。 通过qRT-PCR评估了FMs对TJ相关基因的影响(图1B-F)。结果表明,随着FM浓度的增加,所有治疗组的TJ相关基因的表达都呈上升趋势。BB和BA组表现出更高的保护作用,可能与B. breve和Bacteroides为主的微生物群接种发酵产生的总代谢产物有关。有趣的是,与BB组相比,BA组显著促进了ZO-1、ZO-2、occludin和claudin-3的表达,这意味着BA组的丙酸盐和丁酸盐具有保护肠道屏障完整性的直接调节能力。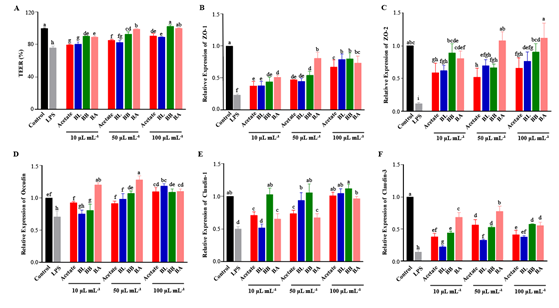
3. 炎症细胞因子表达 图2. FMs对 Caco-2细胞炎症细胞因子和炎症介质的影响。(A-C)IL-6、IL-8和TNF-α的蛋白水平;(D-F)IL-6、IL-8和TNF-α的mRNA水平; (G-J)iNOS、NO、COX-2和 PGE2表达 LPS显著增加促炎细胞因子(即 TNF-α,IL-6,IL-8)的水平,而来自三个肠型组的FM显著抑制这些促炎细胞因子的增加(图2 A-F)。与 BL组相比,BB和 BA组中 IL-6基因的表达水平显著降低,表明三种肠型的FM具有不同的调节炎症的能力。值得注意的是,FM 处理显著降低 IL-8 mRNA和蛋白质的产生浓度依赖的方式(图2A,D)。在相同的干预浓度下,与BL组相比,BB组和BA组的IL-8表达显著降低。此外,FMs剂量依赖性地抑制 NO 浓度和 iNOS 和 COX-2的基因表达(图2G-J)。 总的来说,所有婴儿肠型的 FM 可以抑制促炎细胞因子和其他肠上皮细胞介质的分泌,从而支持更平衡的免疫应答。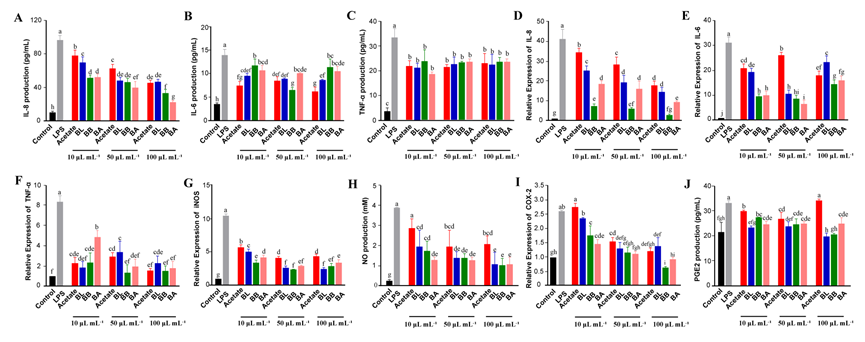
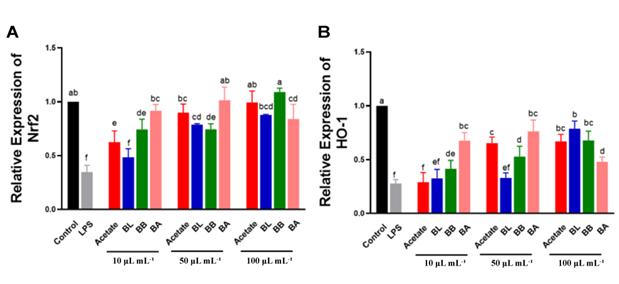
4. 炎症信号通路 图3. FMs对LPS诱导的Caco-2细胞中(A)TLR4、(B)Myd88、(C)p65和(D)MLCK的mRNA水平的影响 浓度为100μL/mL的 FM干预显著降低了 BL/BB/BA 组的 TLR4/NF-κB/MLCK 信号传导途径的基因表达,其中BA组的基因表达水平在三组中最低,这可能与丁酸盐和丙酸盐的产生有关(图3A-C)。值得注意的是,在 BA 组中,MLCK 基因表达随着干预浓度增多显著降低(图3D)。 图4. FMs对LPS诱导的Caco-2细胞中(A)Nrf2、(B)HO-1的mRNA水平的影响 与 LPS 组相比,在10μL/mL FM 干预浓度下,各组(BL组除外) Nrf2和 HO-1基因表达均显著上调。在 BL/BB 组中,Nrf2和 HO-1基因的表达随着 FM 干预浓度的增加而增加。值得注意的是,与100μL/mL FM 干预浓度相比,BA 组在10和50μL/mL FM 干预浓度下显著促进 Nrf2和 HO-1的表达,这与更复杂的丁酸盐和丙酸盐产生有关。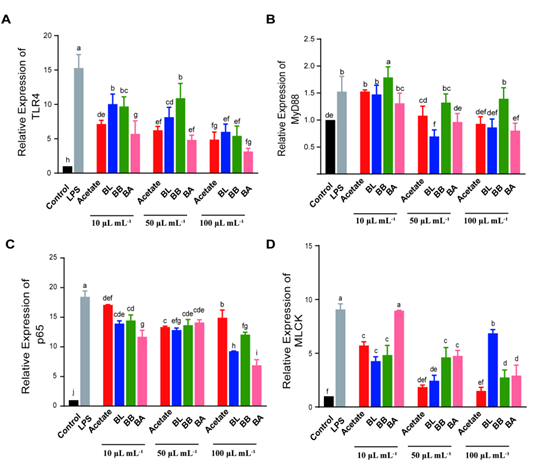
总结 本研究采用三种婴幼儿肠型(B. longum、B. breve和Bacteroides为主)的粪便在2′-FL发酵过程中获得HMO衍生代谢产物。B. longum、B. breve肠型的粪便发酵代谢产物主要是乙酸和乳酸,而Bacteroides肠型产生更丰富的丙酸、丁酸和琥珀酸。所有肠型FM 通过抑制 TLR4/NF-κB/MLCK 信号传导途径并激活 Nrf2/HO-1途径来减少炎性细胞因子如 NO,TNF-α,IL-8,IL-6的产生,并防止 LPS 诱导的肠上皮细胞屏障损伤。我们的研究为开发婴幼儿个性化营养的配方产品提供了一个新的思路。 参考文献 [1] Gu,Z.P., Xu, S. Q., Zheng, Y. X., et al. (2024). In vitro faecal fermentation metabolites of 2′-fucosyllactose protect against intestinal epithelial injury: Infant enterotype effects. International Dairy Journal, 150, 105860. [2] Lv, H. Q., Li, Q. Q., Zhou, Z. N., et al. (2023). The protective effect of 20-fucosyllactose on LPS-induced colitis suckling mice by ameliorating intestinal inflammation and modulating gut microbiota. Food Bioscience, 51, 102317. [3] Fernandez-Veledo, S., & Vendrell, J. (2019). Gut microbiota-derived succinate: Friend or foe in human metabolic diseases? Reviews in Endocrine & Metabolic Disorders, 20, 439e447.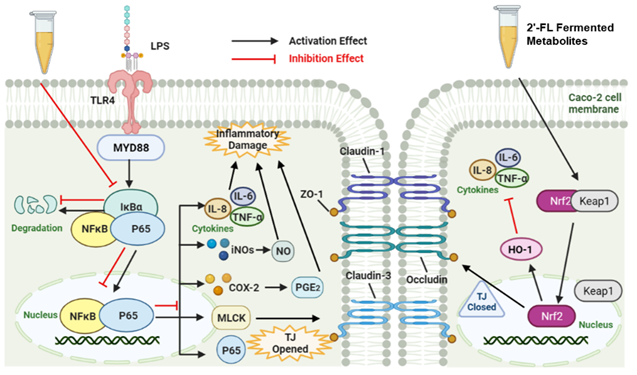
(文章来源:合生元营养与护理研究院公众号)




