近日,健合集团爱尔兰研究中心联合爱尔兰农业与食品发展部在国际权威期刊《Biomolecules》上发表了一项最新研究成果[1]。该项目由健合集团研究中心科学家Jonathan Lane主持,研究揭示了特定的母乳低聚糖(HMOs)组合,尤其是2’-岩藻糖基乳糖(2’-FL)和6’-唾液酸乳糖(6’-SL)的组合在体外肠道炎症模型中调节免疫反应的作用,为开发更贴近母乳结构、更有益处的婴幼儿奶粉配方提供了理论依据。
研究背景
人类免疫系统是一套复杂的防御机制,自出生前开始发展,并在出生后随着身体遇到新的分子信号而继续发展。新生儿期迅速适应以防御病原体,但易倾向于Th2表型对抗细胞外病原体。外界因素可能破坏免疫平衡,引发炎症反应,导致疾病的发生。母乳喂养有助于降低这些疾病风险,支持肠道和免疫系统成熟。母乳低聚糖作为母乳中第三大固体成分,对婴儿早期发育至关重要,不仅促进肠道有益菌的生长,还能降低过敏风险,支持认知功能[2]。HMOs通过调节免疫细胞的激活和细胞因子的产生,减少炎症并促进组织修复,显示出其在调节免疫反应和维护肠道健康的重要性[3]。本研究旨在探索特定的商业化HMOs组合是否能模拟天然HMO的免疫调节作用,通过建立肠道上皮细胞和和巨噬细胞的共培养模型来模拟肠道炎症的特征,用于研究不同HMO组合的免疫调节作用。
主要结果
1. 不同结构HMO的组合对炎症反应的免疫调节效果有显著差异。其中,2 ' -FL+ 6 ' -SL组合中促炎因子IL-8的释放水平最低,抑制炎症效果最好。此外,与对照组(Glucose组)相比,处理组中HMO多样性的增加(4-HMO、5-HMO)对抑炎效果没有显著影响;
2. 浓度依赖试验结果表明,低浓度HMO处理组的免疫调节作用减弱,但高浓度处理并没有观察到比标准剂量更显著的免疫调节效果,特别是对于促炎因子IL-8的释放。与对照组(Glucose组)相比,2 ' -FL、6 ' -SL及其联合处理均能降低促炎细胞因子水平,并与母乳HMO处理组(BM-HMO)有相似的表现;
3. 比例依赖试验结果表明, 2 ' -FL+ 6 ' -SL的组合比例在2:1到4:1之间(初乳、过渡乳的比例)时,其免疫调节效果优于6:1的比例(成熟乳比例)。
研究方法
本研究建立了肠上皮Caco-2细胞和THP-1巨噬细胞的体外共培养模型,模拟炎症状态下的肠道环境,并用LPS和IFN-γ预刺激THP-1细胞诱导炎症反应。在确定了最佳刺激后条件后,将HMO成分引入,并使用ELISA和Bio-Plex Magpix技术定量评估细胞因子表达的变化。此外,使用TEER作为指示性测量来评估这些组合对屏障完整性的影响。实验结果通过方差分析(ANOVA)和Turkey测试进行统计分析,以确定HMO成分在模拟肠道炎症模型中的免疫调节作用。

图1 体外Caco-2肠上皮细胞和THP-1巨噬细胞的共培养炎症模型示意图
研究结果
1. 不同结构HMO组合对促炎细胞因子释放的影响
在优化和建立炎症模型后,检测上清液促炎因子IL-8释放水平,来评价不同HMOs组合及单个结构HMO的抗炎作用,HMOs按照欧盟批准的新型食品清单以最高批准浓度使用,如表1所示。IL-8的定量分析结果如图2所示,不同HMOs组合上清液中的IL-8水平有显著差异。除LNnT 组外(p < 0.0001),所有HMO处理组的IL-8水平与母乳HMO组(BM-HMO)相似。其中2 ' -FL和 6 ' -SL联合使用时,检测到的IL-8水平相比对照组(Glucose)降低了63.7±17.21% (p = 0.0001)。有趣的是,与对照组(Glucose)相比,增加HMO数量(4-HMO或5-HMO)并未显著降低IL-8水平。
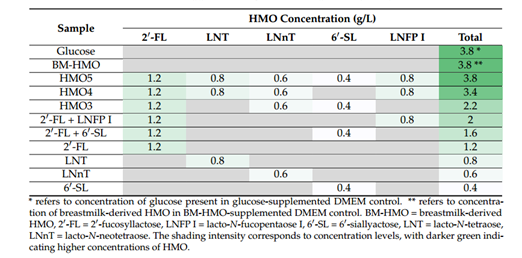
表1 不同处理组HMO组成及对应浓度
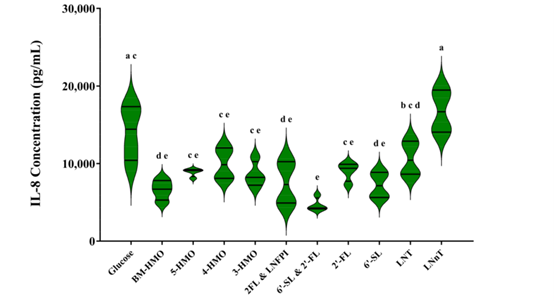
图2 不同HMOs组合处理后促炎因子IL-8的释放水平
2.不同浓度HMO组合对细胞因子释放的影响
使用不同浓度的2 ' -FL (0.6-2.4 g/L)和6 ' -SL (0.2-0.8 g/L)重复共培养实验(见表2),以确定这些HMO成分的免疫调节作用是否具有浓度依赖性,结果如图3所示。抗炎因子IL-10仅在标准浓度和高浓度的BM-HMO组,对照组(Glucose), 2′ -FL + 6′ -SL组以及6′ -SL组中被检测到。所有处理组上清液中均检测到促炎因子IL-1β、IL-6、IL-8、TNF-α和IFNγ的释放。一般来说,低浓度HMO处理的免疫调节作用减弱,但高浓度处理并没有观察到更好的免疫调节效果,特别是对于促炎因子IL-8的释放。与对照组(Glucose)相比,在所有浓度下2 ' -FL单独或与6 ' -SL联合处理都降低了促炎因子TNF-α的表达(p < 0.0001),且均导致炎症细胞因子水平降低(IL-8、IL-1β、IL-6、IFNγ),且与BM-HMO组的结果相似。
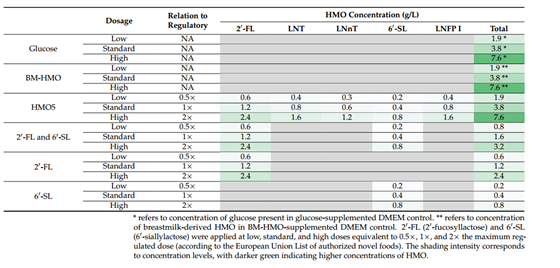
表2 浓度依赖试验中HMOs组合及浓度

图3 浓度依赖试验中各细胞因子的释放热图
3. 不同比例HMO组合对细胞因子释放的影响
将这2 ' -FL和6 ' -SL 两种HMO以不同浓度(0.2 g/L至1.2 g/L)和不同比例(2:1至6:1)组合应用于炎症模型,以探究这两种成分在降低肠道炎症标志物方面的潜在协同作用。与对照组(Glucose)相比,BM-HMO处理降低了所有促炎细胞因子(IL-1β、IL-6、IL-8和TNF-α)的表达(p < 0.05)。有趣的是,研究发现将2-HMO(2 ' -FL: 6 ' -SL)以类似于初乳与过渡乳的比例(2:1到4:1之间)处理,其结果优于以6:1比例(成熟乳和后期乳比例)处理。与对照组(Glucose)相比,0.6 g/L 2′-FL和0.3 g/L 6′-SL(比例为2:1,总= 0.9 g/L)的处理组显著降低了促炎因子IL-1β和IL-8的表达(p < 0.05),而1.2 g/L 2′-FL和0.2 g/L 6′-SL(比例为6:1,总= 0.9 g/L)对这些促炎细胞因子的表达无显著影响。此外,在2 ' -FL和6 ' -SL的所有联合处理中均检测到抗炎因子IL-10的表达,且IL-10的表达不依赖于组合比例,在所有处理组中检测到相似的水平(p > 0.05)。
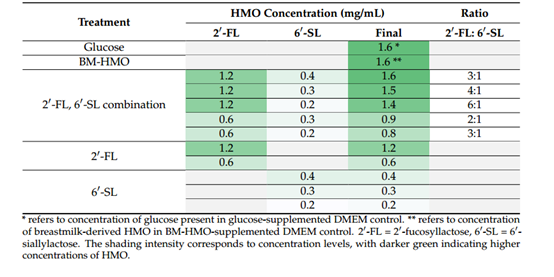
表3 比值依赖试验中HMOs组合及浓度
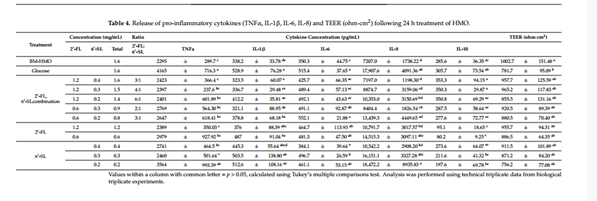
表4 比值依赖试验中各细胞因子释放水平和TEER(ω·cm2)数值
结论
本研究建立了Caco-2肠上皮细胞和THP-1巨噬细胞共培养模型,探讨母乳低聚糖(HMOs)对肠道炎症性疾病的抗炎作用。研究结果揭示了HMOs的特定组合2 ' -FL和6 ' -SL能有效降低促炎细胞因子水平,强调了特定的HMOs组合在婴幼儿配方奶粉中模拟母乳的益处和预防过度炎症的应用潜力。研究结果强化了结构不同的HMO具有不同生物活性的概念,并首次发现某些HMOs,即6 ' -SL和2 ' -FL,可以调节与炎症相关的肠上皮细胞反应。综上所述,含2′-FL和6′-SL的HMOs可作为维持肠道功能和降低炎症反应的功能性食品成分。值得注意的是,具体的相互作用和结果可能取决于不同HMO的结构、组合的浓度和研究的条件。
参考文献
[1] Walsh C, Lane JA, van Sinderen D, Hickey RM. Tailored Combinations of Human Milk Oligosaccharides Modulate the Immune Response in an In Vitro Model of Intestinal Inflammation. Biomolecules. 2024; 14(12):1481.
[2] Walsh, C.; Lane, J.A.; van Sinderen, D.; Hickey, R.M. Human milk oligosaccharides: Shaping the infant gut microbiota andsupporting health. J. Funct. Foods 2020, 72, 104074.
[3] He, Y.; Liu, S.; Kling, D.E.; Leone, S.; Lawlor, N.T.; Huang, Y.; Feinberg, S.B.; Hill, D.R.; Newburg, D.S. The human milk oligosaccharide 2′-fucosyllactose modulates CD14 expression in human enterocytes, thereby attenuating LPS-induced inflammation. Gut 2016, 65, 33–46.




